Содержимое файла:

NH 3

Строение атома азота
N
14
2p
7
N
Азот
2 s
2
5
2 s 2 2p 3
7 N II период
V группа
На внешнем уровне атома азота – валентные s -орбиталь,
на которой находятся два спаренных электрона, и три
p- орбитали, на каждой из которых по одному
неспаренному электрону.
:
:
:
:
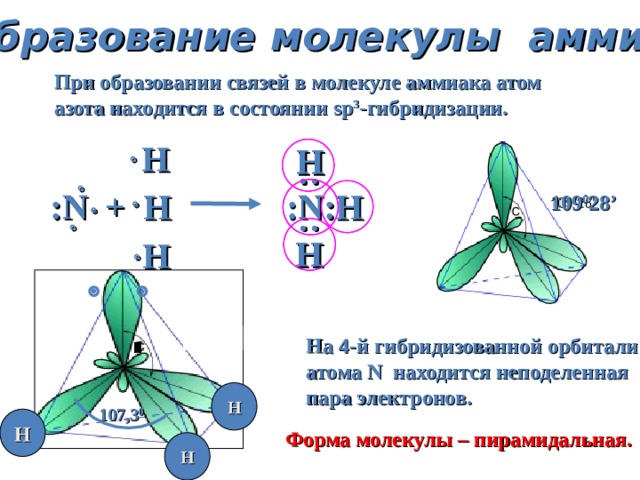
Образование молекулы аммиака
При образовании связей в молекуле аммиака атом
азота находится в состоянии sp 3 — гибридизации.
Н
Н
Н
: N + H : N :Н
109 0 28 ’
Н
Н
Н
На 4-й гибридизованной орбитали
атома N находится неподеленная
пара электронов.
Н
107,3 0
Н
Форма молекулы – пирамидальная.
Н

Строение молекул аммиака
Связи N-H полярные, молекула имеет пирамидальную форму, общие электронные пары смещены в сторону
атома азота. Одна из вершин занята неподеленной парой электронов. Молекула сильно полярна.
Между молекулами аммиака образуются водородные связи:
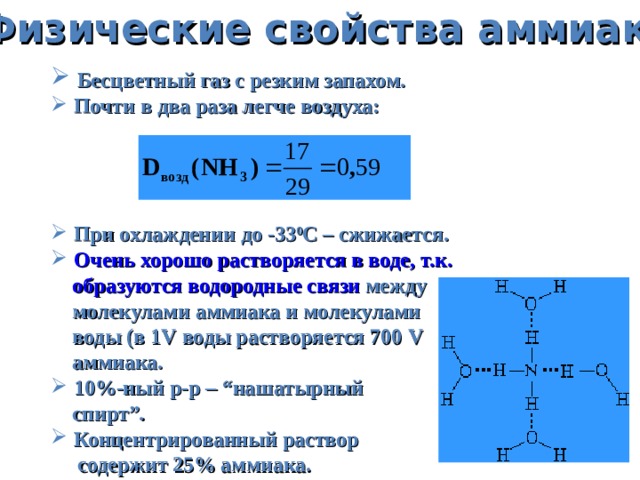
Физические свойства аммиака
- Бесцветный газ с резким запахом.
- Почти в два раза легче воздуха:
- При охлаждении до -33 0 С – c жижается.
- Очень хорошо растворяется в воде, т.к.
образуются водородные связи между
молекулами аммиака и молекулами
воды (в 1 V воды растворяется 700 V
аммиака.
- 10%-ный р-р – “ нашатырный
спирт ” .
- Концентрированный раствор
содержит 25% аммиака.

Способы получения аммиака
В промышленности:
N 2 + 3H 2 2NH 3
Реакция проводится при нагревании, под давлением,
в присутствии катализатора.
В лаборатории:
- Действием щелочей на соли аммония:
2NH 4 Cl + Ca(OH) 2 = CaCl 2 + 2NH 3 + 2H 2 O
- Гидролиз нитридов:
Mg 3 N 2 + 6H 2 O = 3Mg(OH) 2 + 2NH 3

Химические свойства аммиака
-3
NH 3 – низшая степень окисления азота.
I. Аммиак — восстановитель
- Реакция горения аммиака:
4NH 3 + 3O 2 = 2N 2 + 6H 2 O
- Каталитическое окисление аммиака:
4NH 3 + 5O 2 = 4NO + 6H 2 O
- Аммиаком можно восстановить некоторые
неактивные металлы:
3CuO + 2 NH 3 = 3Cu + N 2 + 3H 2 O

II. Основные свойства аммиака:
- При растворении аммиака в воде образуется
гидрат аммиака, который диссоциирует:
NH 3 + H 2 O NH 3 H 2 O NH 4 + + OH —
ион аммония
Изменяет окраску индикаторов :
Фенолфталеин – б / цв малиновый
Метилоранж – оранжевый желтый
Лакмус – фиолетовый синий
- С кислотами образует соли аммония:
NH 3 + HCl = NH 4 Cl хлорид аммония
2NH 3 + H 2 SO 4 = (NH 4 ) 2 SO 4 сульфат аммония
NH 3 + H 2 SO 4 = NH 4 HSO 4 гидросульфат аммония
:
:
:
:
:
:
:
:
:
:
:
:
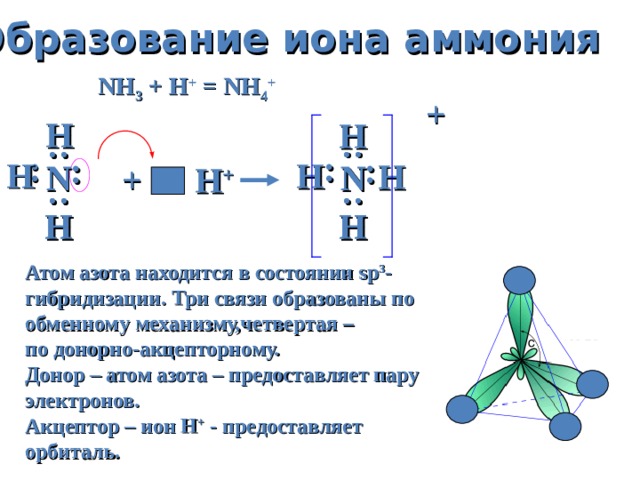
Образование иона аммония
NH 3 + H + = NH 4 +
+
Н
Н
Н
Н
Н
N
N
N
N
+ H +
Н
Н
Н
Н
Атом азота находится в состоянии sp 3 — гибридизации. Три связи образованы по обменному механизму,четвертая –
по донорно-акцепторному.
Донор – атом азота – предоставляет пару электронов.
Акцептор – ион Н + — предоставляет
орбиталь.

Соли аммония
Ион аммония по размерам и заряду близок к
ионам щелочных металлов, поэтому соли
аммония похожи на соли щелочных металлов.
- Кристаллические вещества.
- Белого цвета.
- Хорошо растворяются в воде. Их растворение
в воде сопровождается поглощением тепла.
Качественная реакция на ион аммония –
взаимодействие солей с растворами щелочей:
NH 4 NO 3 + NaOH = NaNO 3 + NH 3 + H 2 O
характерный резкий
запах аммиака

Разложение солей аммония при нагревании
- Соли летучих кислот:
NH 4 Cl = NH 3 + HCl
(NH 4 ) 2 CO 3 = 2NH 3 + CO 2 + H 2 O
- C оли нелетучих кислот:
(NH 4 ) 2 SO 4 = NH 4 HSO 4 + NH 3
(NH 4 ) 3 PO 4 = (NH 4 ) 2 HPO 4 + NH 3 без нагревания
(NH 4 ) 2 HPO 4 = NH 4 H 2 PO 4 + NH 3 при нагревании
- Соли с анионом-окислителем:
(NH 4 ) 2 Cr 2 O 7 = N 2 + Cr 2 O 3 + 4H 2 O
NH 4 NO 3 = N 2 O + 2H 2 O
NH 4 NO 2 = N 2 + 2H 2 O
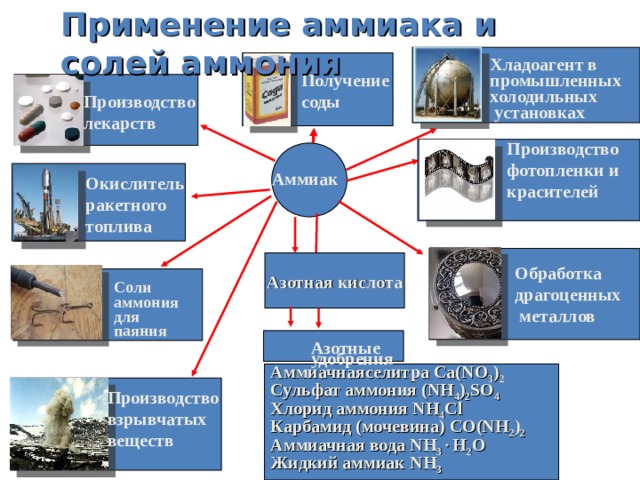
Применение аммиака и солей аммония
Хладоагент в
промышленных
холодильных
установках
Получение
соды
Производство
лекарств
Производство
фотопленки и
красителей
Аммиак
Окислитель
ракетного
топлива
Азотная кислота
Обработка
драгоценных
металлов
Соли
аммония
для
паяния
Азотные
удобрения
Аммиачнаяселитра Ca(NO 3 ) 2
Сульфат аммония (NH 4 ) 2 SO 4
Хлорид аммония NH 4 Cl
Карбамид (мочевина) CO(NH 2 ) 2
Аммиачная вода NH 3 H 2 O
Жидкий аммиак NH 3
Производство
взрывчатых
веществ

